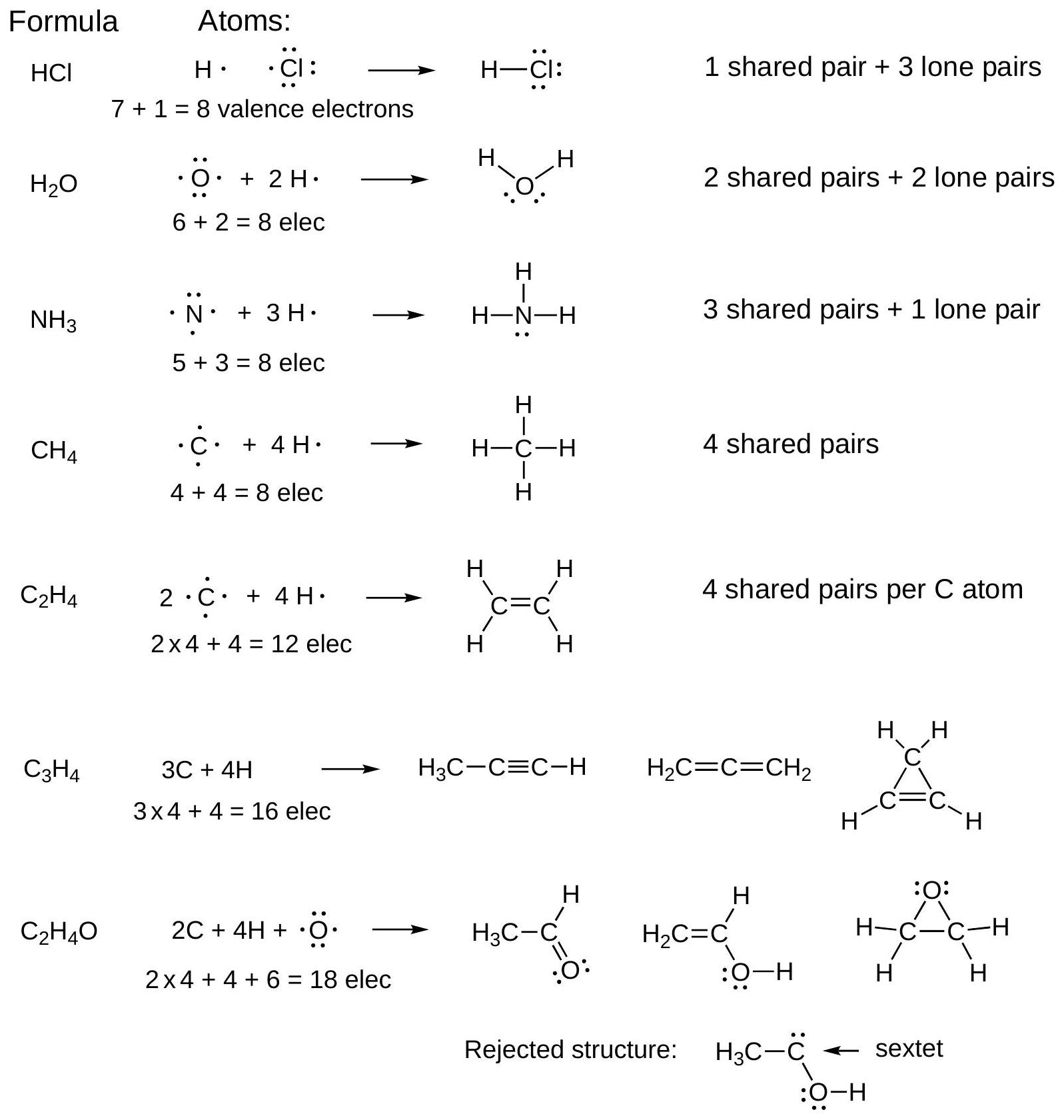
Chapter1
1 什么是键?
在第1页和第2页,我们简要回顾了化学键的物理基础。这段讨论不会出现在考试中,因为它不在麦克默里(McMurry)的教材中。它在这里的目的是引入这样一个原理:如果分子采用具有离域(分散)电子分布的几何构型,其能量会更低。麦克默里在课文的几个地方讨论了这一点,尤其是在具有π键的分子中。
1916年,G. N. Lewis提出,键是由两个原子共享的电子对形成,使得两个原子都遵守八隅体规则。键最初用两个点或一条线表示。如今,键用线表示,而路易斯点则用于表示孤对电子(非键合电子对)。
H₂和水的路易斯结构:
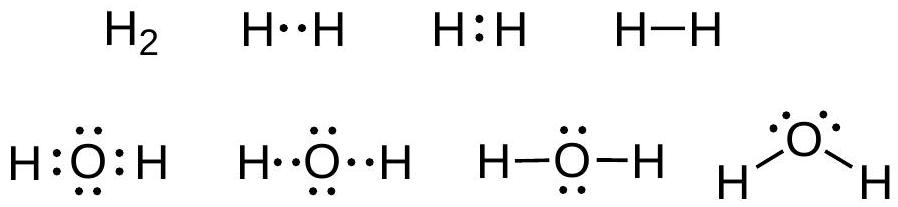

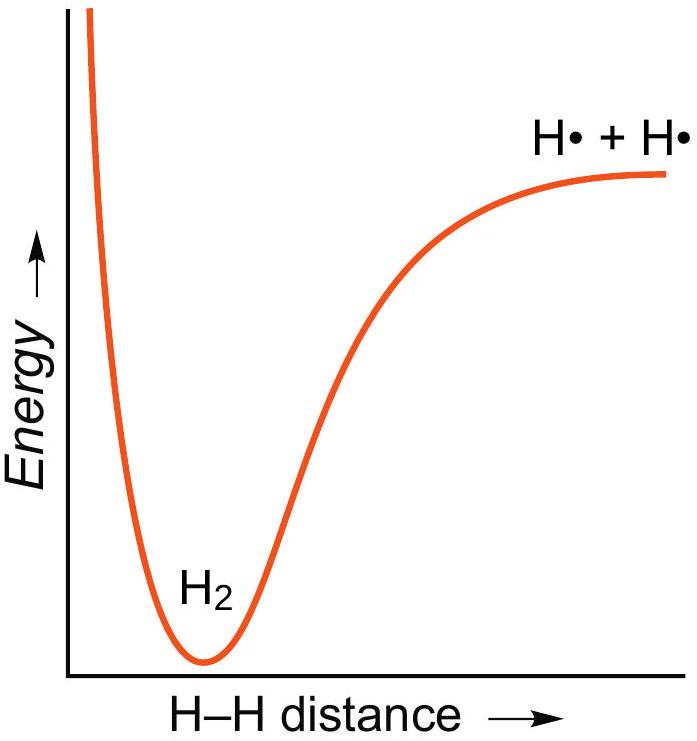
共价键是一种量子现象——它没有经典类比。考虑H₂中的H-H键。当两个H原子相互靠近,它们的1s轨道重叠时,就形成了键。这意味着当原子核靠近(但不过于靠近)时,能量会更低,如右侧图所示。这种能量的降低就是键。H-H键并非连接H原子的独立物理实体,它仅仅是能量-距离曲线右侧的低能量区域。
但什么使能量更低呢?
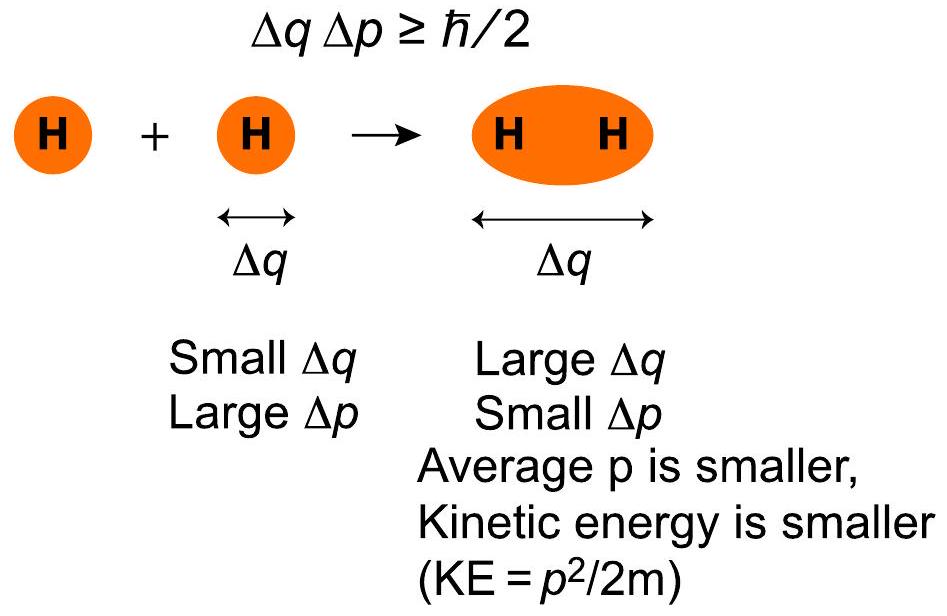
经典和量子效应共同作用,使键合区域的能量降低。库仑定律给出了带电粒子之间的经典静电力(同性相斥,异性相吸)。形成共价键需要两种量子效应。其一是海森堡不确定性原理,,其中是电子密度的空间范围(电子位置的不确定性),是电子动量的范围,是普朗克常数除以。电子运动的空间大小(,橙色区域)在H₂中比在H原子中更大。这意味着在H₂中比在H原子中更小。键的形成创造了一个平均电子动量更低的空间。这降低了电子动能()。因此,分子倾向于采用电子密度离域(分散)的几何构型,因为形成低能量分子的概率高于形成异构高能量分子的概率。
另一个对键合很重要的量子效应是泡利不相容原理,它指出原子或分子中没有两个电子可以拥有相同的量子数集。例如,如果两个电子占据同一个空间轨道,它们必须具有相反的自旋。由于电子波函数的这一限制,电子可以占据所有成键分子轨道,而不仅仅是最低能量的轨道。因此,分子可以采用特定的形状,并且块状物质可以占据空间体积。
2 八隅体规则Octet Rule:一个分子只有在每个原子共享8个价电子时才是稳定的。
给定分子式,可以使用八隅体规则推断分子的键连接方式。
在排列键和孤对电子以满足八隅体规则时,请遵循以下电子计数指南:
- 对于一个键,每个原子共享该电子对。两个电子都是每个原子八隅体的一部分。
- 孤对电子的两个电子都被分配给一个单一原子。
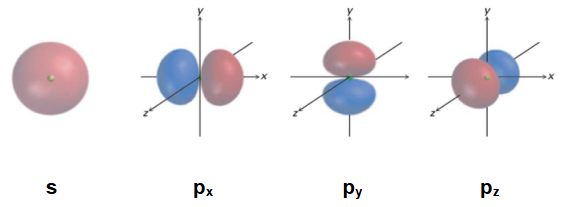
原子轨道
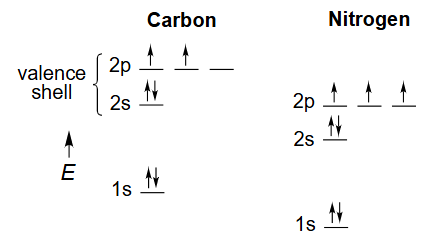
C、N原子基态
3 3-D 分子几何结构和杂化
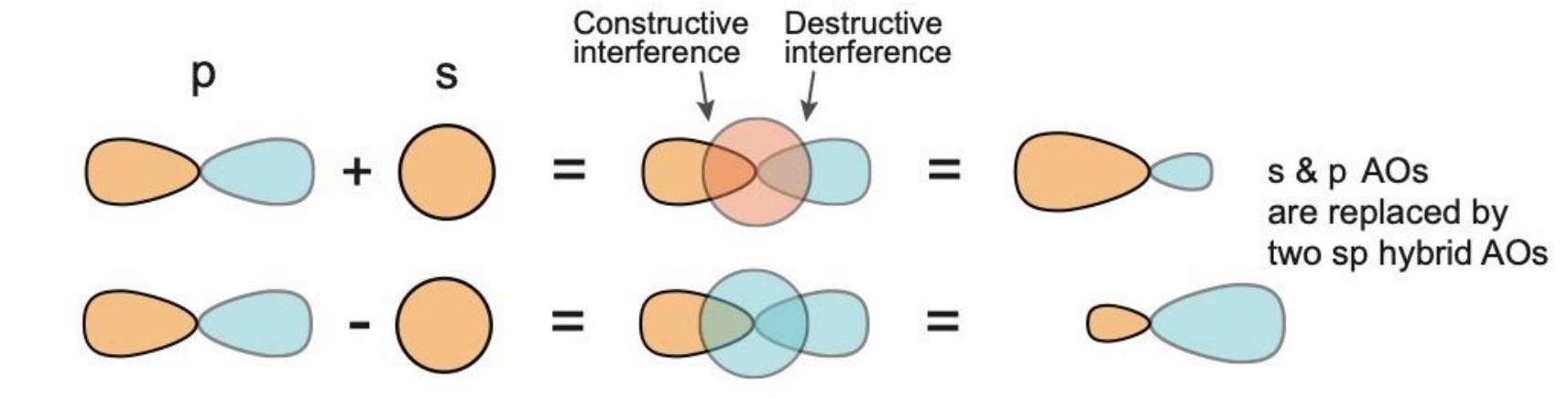
杂化解决了以下问题: 如果我们知道分子的几何构型,如何理解其键合bonding? 键合需要相邻原子轨道(AOs)的重叠。 杂化产生单向原子轨道,以实现更有效的键合。
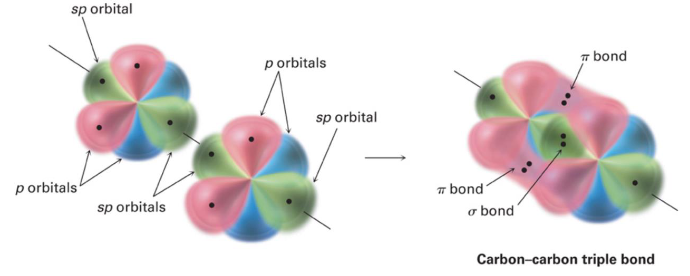
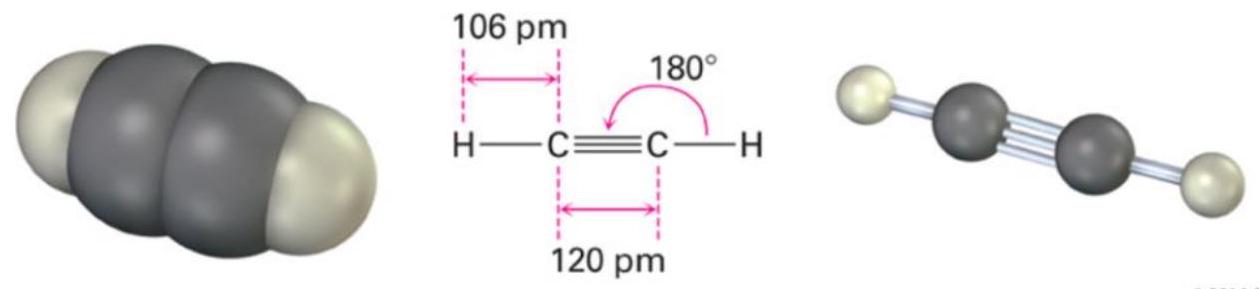
| 线性(乙炔) acetylene |
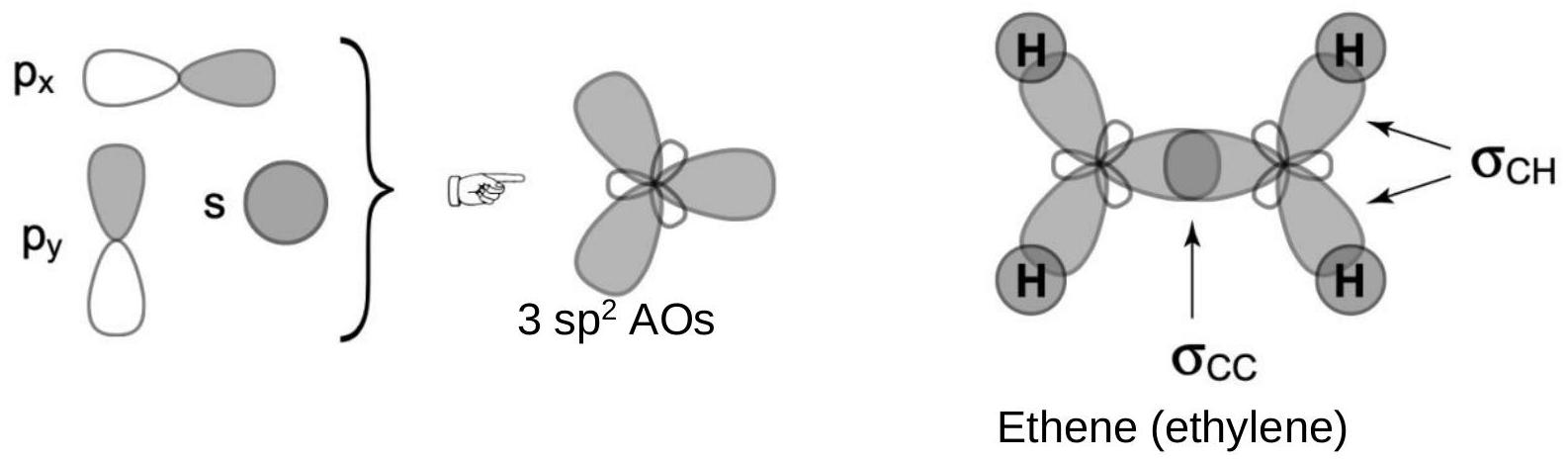
平面(乙烯) ethylene |
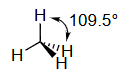
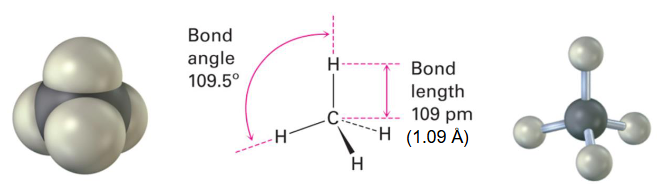
非平面(甲烷) methane |
|
|---|---|---|---|
 |
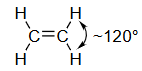 |
 |
|
| 杂化: Hybridization |
sp | ||
| s特征: s-character |
50% | 33% | 25% |
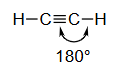
为了在x轴上形成具有180°键角的乙炔,每个碳原子需要一个p_x原子轨道与一个s原子轨道混合(sp杂化),如下图所示。s和p_x原子轨道混合,形成一对沿x轴指向相反方向(180°键角)的sp杂化原子轨道。
sp
在每个碳原子上,s和p原子轨道混合形成一对sp杂化原子轨道:
碳的s、p_x和p_y原子轨道结合形成3个在x-y平面上的sp²原子轨道。
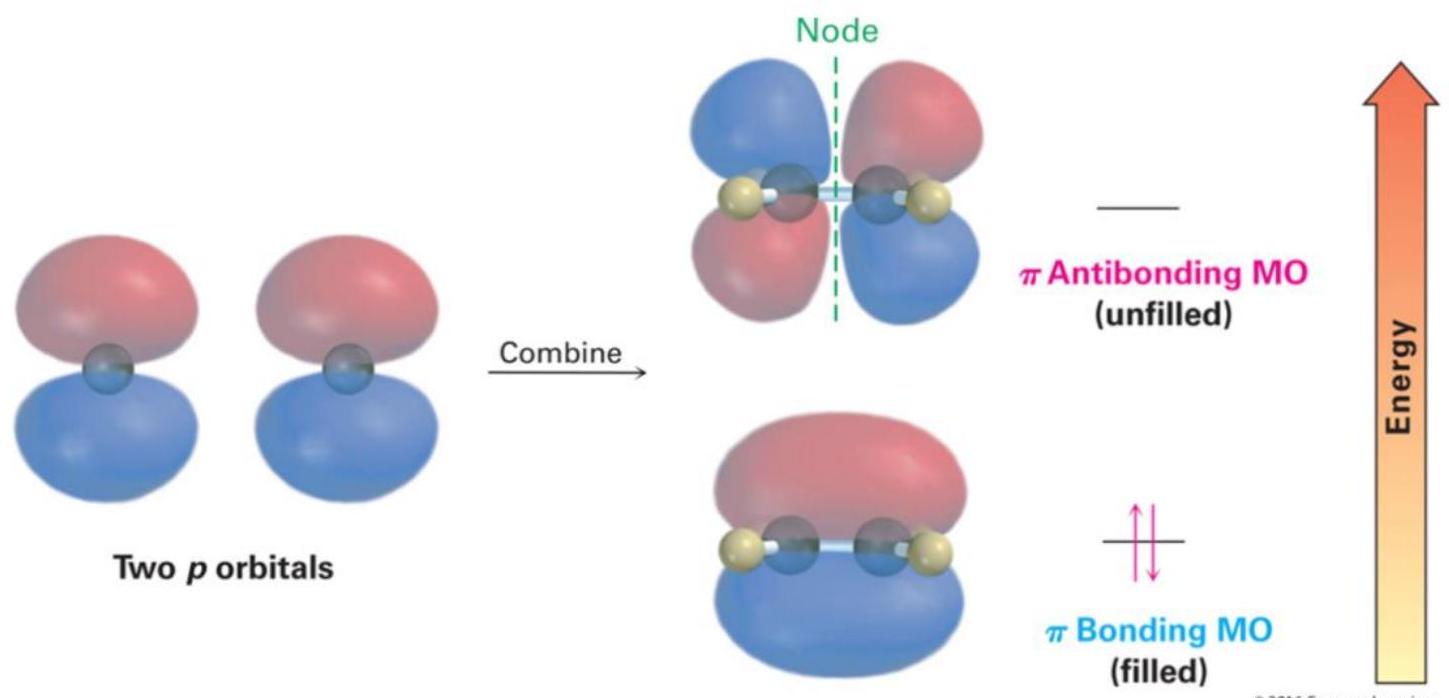
 侧视图
侧视图
 俯视图
俯视图
轨道垂直于sp 骨架
碳的s、p_x、p_y、p_z原子轨道结合形成四个具有四面体对称性的sp³杂化原子轨道。


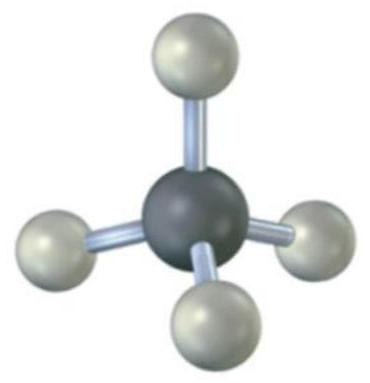
4 根据键连接bond connectivity方式预测杂化hybridization
4.1 计算与一个原子相连的原子数量 + 孤对电子数量
sp³ 原子数量 + 孤对电子数量 = 4 sp² 原子数量 + 孤对电子数量 = 3 sp 原子数量 + 孤对电子数量 = 2
4.2 每个杂化原子都与一个键角相关联,这是一个可测量量。杂化仅对连接到个其他原子的原子明确定义,这定义了一个键角。
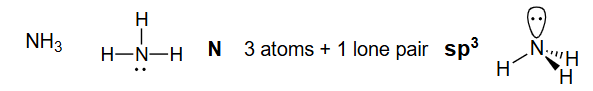
N 3个原子 +1个孤对电子

O 2个原子 + 2个孤对电子
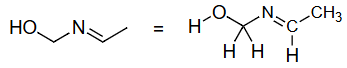
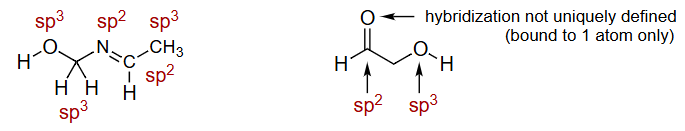
杂化轨道不是唯一定义的(仅限于一个原子)
4.3 具有C、N、O八隅体的常见结构:
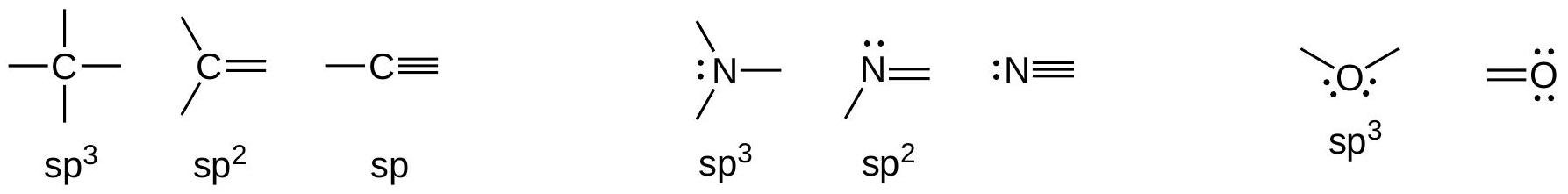
4.4 绘制结构:
如何表示键连接性
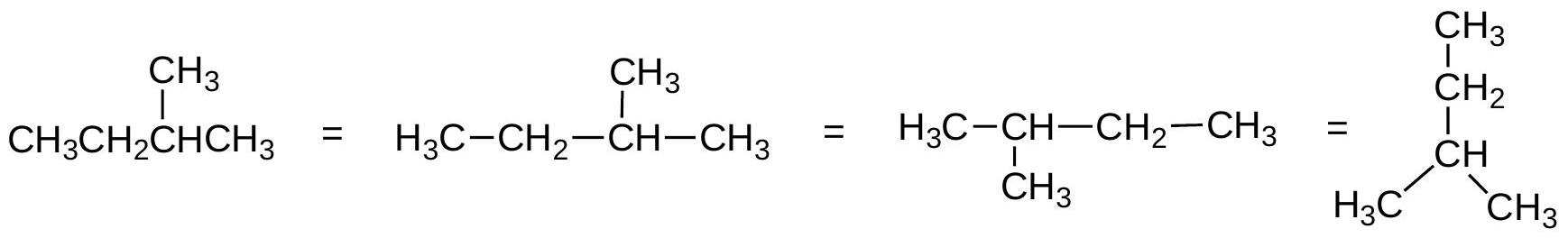
4.5 绘图约定:
- 绘制C-C键,省略C和H标签,除非H连接到杂原子(非碳原子)时才包括H。
- C原子位于拐角处(2个或更多C-C键的交点)和链的末端。
- 连接到C的H原子数量由八隅体规则推断。
上面的分子:


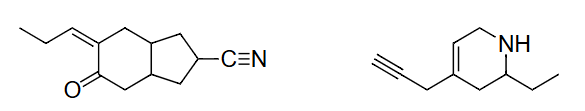
修订上面2个结构,包含每个碳原子上的所有C-H键。